Elvanse
| Elvanse | |
|---|---|
| |
| Wirkstoff | Lisdexamfetamindimesilat |
| Verfügbare Dosierungen |
|
| Darreichungsform | Hartkapseln zur oralen Anwendung (nicht teilbar) |
| Wirkmechanismus | Prodrug von Dexamfetamin (indirektes Sympathomimetikum) |
| Hersteller | Takeda GmbH |
Elvanse ist ein Arzneimittel mit dem Wirkstoff Lisdexamfetamin (LDX), das zur Behandlung von ADHS vorgesehen ist. Elvanse besitzt eine Zulassung für das Kindes- und Jugendalter sowie eine erweiterte Zulassung für das Erwachsenenalter.
Wirkungsweise
Lisdexamfetamin ist ein kovalent an L-Lysin gebundenes Prodrug von D-Amfetamin, das nach oraler Einnahme zunächst pharmakologisch weitgehend inaktiv ist. Erst nach der Resorption wird es vor allem in den Erythrozyten enzymatisch zu L-Lysin und freiem D-Amfetamin gespalten. Diese metabolismusabhängige Freisetzung führt zu einem vergleichsweise allmählichen Anstieg der D-Amfetamin-Plasmaspiegel und trägt zu dem relativ gleichförmigen Wirkprofil über mehrere Stunden bei. Da die Geschwindigkeit der Freisetzung primär durch den Metabolismus und weniger durch Galenik oder Applikationsweg bestimmt ist, wird ein Teil des kurzfristigen Missbrauchspotenzials im Vergleich zu sofort freisetzenden Amfetaminpräparaten abgeschwächt, auch wenn es pharmakodynamisch ein „klassisches“ Amfetamin bleibt.
Das freigesetzte D-Amfetamin wirkt überwiegend als indirektes Sympathomimetikum im Zentralnervensystem. Es fungiert als Substrat an Dopamin- (DAT) und Noradrenalintransportern (NET) und erhöht die extrazelluläre Konzentration beider Neurotransmitter, indem es deren Wiederaufnahme hemmt und die präsynaptische Freisetzung aus Vesikeln fördert. Besonders relevant für die ADHS-Symptomatik ist die gesteigerte dopaminerge und noradrenerge Transmission in präfrontalen Netzwerken, die an Aufmerksamkeitssteuerung, Arbeitsgedächtnis und inhibitorischer Kontrolle beteiligt sind. In der klinischen Beobachtung gehen diese neurochemischen Effekte mit Verbesserungen von Unaufmerksamkeit, Impulsivität und Hyperaktivität einher, wobei interindividuelle Unterschiede in Pharmakokinetik, -dynamik und Vulnerabilität für Nebenwirkungen beträchtlich bleiben.
Wirkbeginn und -Dauer
Etwa 30 bis 60 Minuten nach oraler Einnahme darf mit einem ersten subjektiven Wirkungseintritt gerechnet werden. Die maximalen Plasmaspiegel von Lisdexamfetamin selbst werden im Mittel nach rund 1 Stunde (Tₘₐₓ ≈ 0,8–1,5 h) erreicht, während die Konzentration des pharmakologisch aktiven Metaboliten D-Amfetamin typischerweise erst nach etwa 3–4 Stunden (Tₘₐₓ ≈ 3–4,5 h) ihren Peak erreicht. Die klinisch relevante Hauptwirkung baut sich daher über die ersten 2–4 Stunden nach Einnahme auf und bleibt im Erwachsenenalter meist für etwa 10–12 Stunden spürbar, vereinzelt auch bis zu 13–14 Stunden, bevor sie graduell abklingt. Faktoren wie Nahrungsaufnahme, individuelle Unterschiede in Resorption und Metabolismus oder Körpergewicht können diese Zeitfenster um grob ±30–60 Minuten verschieben, ohne das grundsätzliche Wirkprofil wesentlich zu verändern.
Wirkstoffanteil
Die folgende Tabelle stellt die Wirkstoffverteilung des aktiven d-Amfetamins pro Kapsel dar:[1]
| Kapseldosis | Anteil d-Amfetamin |
|---|---|
| 20 mg | 5,9 mg |
| 30 mg | 8,9 mg |
| 40 mg | 11,9 mg |
| 50 mg | 14,8 mg |
| 60 mg | 17,8 mg |
| 70 mg | 20,8 mg |
Einnahme
Abhängigkeit von der Nahrungsaufnahme
Elvanse kann unabhängig von der Nahrungsaufnahme eingenommen werden. Nach fettreicher Mahlzeit kann der Spitzenplasmaspiegel um etwa eine Stunde verzögert sein.[2] Zwar bleibt die insgesamt aufgenommene Wirkstoffmenge (Area Under The Curce; AUC) im Wesentlichen unverändert, jedoch verschiebt sich der Zeitpunkt des maximalen Plasmaspiegels von D-Amfetamin nach hinten, sodass der subjektive Wirkungseintritt und die maximale klinische Wirkung etwas später einsetzen können. Klinisch ist dies meist unproblematisch, kann aber bei Personen, die auf einen definierten Wirkbeginn am Morgen angewiesen sind (z. B. vor Schul- oder Arbeitsbeginn), relevant sein; hier kann es sinnvoll sein, auf sehr fettreiche Frühstücksmahlzeiten im direkten zeitlichen Zusammenhang mit der Einnahme zu verzichten oder die Einnahmezeit entsprechend anzupassen.
Eigenschaften des Pulvers
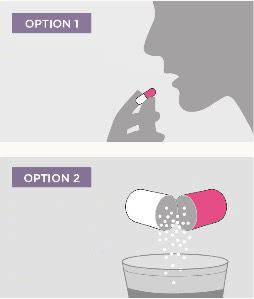
Der Wirkstoff Lisdexamfetamin liegt in den Kapseln von Elvanse als Lisdexamfetamin-Dimesilat vor. Es handelt sich um ein weißes Pulver, das unabhängig von der Kapselhülle eingenommen werden kann – die Kapsel darf daher geöffnet und der Inhalt z. B. unter weiche Nahrung (wie Joghurt, Brei oder Apfelmus) gemischt oder in einem Glas Wasser bzw. Orangensaft aufgelöst werden. Wichtig ist, dass die so zubereitete Dosis vollständig eingenommen wird, damit die vorgesehene Wirkstoffmenge aufgenommen wird. Eventuell zusammenklebende Teilchen können mit einem Löffel zerstoßen und sorgfältig untergerührt werden.
Risiken und Nebenwirkungen
Häufige Nebenwirkungen sind verminderter Appetit, Schlafstörungen, Mundtrockenheit, Kopfschmerzen, Oberbauchschmerzen und Gewichtsabnahme. Ebenfalls relativ häufig beschrieben werden Herzklopfen bzw. erhöhte Herzfrequenz, leichter Blutdruckanstieg, Nervosität, innere Unruhe, Reizbarkeit, emotionale Labilität, Übelkeit, Magen-Darm-Beschwerden (z. B. Bauchschmerzen, Obstipation oder Diarrhö), Schwindel, vermehrtes Schwitzen sowie gelegentlich Tics oder eine Verstärkung bereits bestehender Angst- und Depressionssymptome. Bei missbräuchlicher Verwendung besteht ein Sucht- bzw. Abhängigkeitsrisiko.[3] Zudem können unter unsachgemäßer oder zu hoch dosierter Einnahme in Einzelfällen schwerwiegendere kardiale oder psychiatrische Komplikationen auftreten.
Missbrauch
Die Missbrauchsmöglichkeiten von Elvanse sind gering, da der enthaltene Ausgangsstoff nicht pharmakologisch aktiv ist – erst im Magen-Darm-Trakt kommt es zu einer Spaltung in den psychoaktiven Metaboliten Dexamfetamin. Missbräuchliche Applikationen (etwa Injizieren) sind daher nicht (direkt) mit psychotropen Effekten verbunden. Bei intranasaler Applikation (Sniffen) kann eine indirekte Wirkung zum Tragen kommen, welche jedoch nicht durch die Aufnahme über die Nasenschleimhaut, sondern durch das indirekte Erreichen des Magen-Darm-Traktes über die Speiseröhre geschieht. Sonstiger Missbrauch gestaltet sich in einer peroralen Überdosierung des Medikaments.
Abhängigkeitsrisiko bei missbräuchlicher Anwendung
Es liegen Berichte über Patienten vor, welche die Amfetamin-Dosierung auf das Vielfache der empfohlenen Dosierung erhöht haben.[4] Dabei besteht das Risiko von Toleranzentwicklungen sowie der Entwicklung einer Abhängigkeitserkrankung. Abruptes Absetzen nach längerfristiger hochdosierter Anwendung führt zu extremer Müdigkeit und depressiven Verstimmungen.
Illegale Verfügbarkeit
Angebot und Nachfrage auf Onion-Marktplätzen scheinen gering. Lisdexamfetamin ist dort nur zu sehr hohen Preisen erhältlich. Die Preise für eine Einzeldosis Lisdexamfetamin 70 mg liegen aktuell bei durchschnittlich 5 Euro pro Kapsel.
Gerichtsurteil: Entzug des Führerscheins nach Einnahme von Elvanse Adult
Im Frühjahr 2022 wurde ein ADHS-Patient von der Polizei angetroffen. Der Patient befand sich in ärztlicher Behandlung mit Elvanse Adult. Die Beamten waren der Auffassung, der Patient zeige drogentypische Ausfallerscheinungen. Tatsächlich handelte es sich jedoch um übliche Amphetamin-typische Nebenwirkungen wie Zittrigkeit und geweitete Pupillen, wie aus dem Beschluss des VG Koblenz hervorgeht.[5] Der Patient konnte gegenüber den Beamten vor Ort nicht nachweisen, dass seiner Medikamenteneinnahme eine ärztliche Verordnung zu Grunde liegt. Daraufhin wurden weitere Ermittlungsmaßnahmen ergriffen.[6] Die anschließend durchgeführte toxikologische Untersuchung auf Amphetamine fiel entsprechend positiv aus, woraufhin dem Patienten durch die zuständige Behörde die Fahrerlaubnis entzogen wurde. Der Patient wandte sich per Eilantrag an das VG und legte dort eine sehr einfach ausgeführte Bescheinigung vor, welche aus Sicht des Gerichts jedoch unzureichende Informationen über die Verordnung enthielt. Das Gericht lehnte den Eilantrag ab. Der Patient sei ungeeignet, ein Fahrzeug zu führen, da er eine „harte Droge“ einnehme. Er habe auf Amphetamin zurückzuführende Ausfallerscheinungen gezeigt und trotzdem am Straßenverkehr teilgenommen. Die Schlussfolgerungen des VG Koblenz stehen den wissenschaftlichen Erkenntnissen entgegen, dass Amphetamine und deren Derivate die Fahrleistungen von ADHS-Patienten verbessern, folgerichtig also ihre Eignung zur Teilnahme am Straßenverkehr erhöhen.
Weitere Amphetamine
Siehe auch
Einzelnachweise
- ↑ Elvanse 20 mg Hartkapseln. (o. D.). medikamio. https://medikamio.com/de-de/medikamente/elvanse-20-mg-hartkapseln/pil
- ↑ Otto Benkert u. a.: Kompendium der Psychiatrischen Pharmakotherapie. Springer 2016. ISBN 978-3-662-50333-1. S. 809f.
- ↑ Lisdexamfetamine dimesylate: the first prodrug stimulant. (2007, 1. August). PubMed. http://www.ncbi.nlm.nih.gov/pubmed/20532026?dopt=Abstract%3C/ref%3E
- ↑ vgl. https://www.shire.de/-/media/shire/shireglobal/shiregermany/pdffiles/product%20information/fi-elvanse.pdf
- ↑ https://www.adhs-ausweis.de/Downloads/Beschluss%20Koblenz.pdf
- ↑ https://www.adhs-ausweis.de/beispielfaelle/

